Интервал времени протекания различных химических реакций на
единицу пространства колеблется от долей секунды до минут, часов, дней. Известны реакции,
требующие для своего протекания несколько лет, десятилетий и еще более длительных
отрезков времени. Если реакция протекает в гомогенной системе, то она идет во всем объеме
этой системы. В результате реакции возникает, как правило, гетерогенная система:
H2SO4 + Na2S2O3
= Na2SO4 + H2O + SO2 + S
+ S
Примерами гомогенной системы может служить любая однофазовая смесь, жидкий раствор
различных веществ. Если реакция протекает между веществами, образующими гетерогенную
систему, то она может идти только на поверхности раздела фаз, образующих систему.
Так, например, растворение металла в кислоте Fe + 2HCl = FeCl2 +
H2 может протекать только на поверхности металла, потому что только здесь соприкасаются
друг с другом оба реагирующих вещества. Результатом реакции является опять гетерогенная
система, которая в условиях отсутствия замкнутости может путем освобождения от одной
из своих фаз стать гомогенной системой. В качестве примеров гетерогенных систем можно
привести следующие системы: вода со льдом, насыщенный раствор с осадком, сера в
атмосфере воздуха. На более высоких ступенях Развития Материи примерами гомогенных
систем могут служить заросли функционально однотипных растений (лес, луговая трава,
фруктовые сады), объединенные группы функционально однотипных животных (стадо овец,
стая волков или обезьян). Гетерогенными системами в этом случае будут: табун лошадей
на лугу, бригада лесорубов в лесу, производственные предприятия и т.п. Изучением
условий, влияющих на скорости химических реакций, занимается химическая кинетика.
На более высоких ступенях Развития Материи эти вопросы должны быть отнесены
соответственно к биологической и социальной кинетике.
может протекать только на поверхности металла, потому что только здесь соприкасаются
друг с другом оба реагирующих вещества. Результатом реакции является опять гетерогенная
система, которая в условиях отсутствия замкнутости может путем освобождения от одной
из своих фаз стать гомогенной системой. В качестве примеров гетерогенных систем можно
привести следующие системы: вода со льдом, насыщенный раствор с осадком, сера в
атмосфере воздуха. На более высоких ступенях Развития Материи примерами гомогенных
систем могут служить заросли функционально однотипных растений (лес, луговая трава,
фруктовые сады), объединенные группы функционально однотипных животных (стадо овец,
стая волков или обезьян). Гетерогенными системами в этом случае будут: табун лошадей
на лугу, бригада лесорубов в лесу, производственные предприятия и т.п. Изучением
условий, влияющих на скорости химических реакций, занимается химическая кинетика.
На более высоких ступенях Развития Материи эти вопросы должны быть отнесены
соответственно к биологической и социальной кинетике.
К важнейшим факторам, влияющим на скорости реакций, протекающих
в системах уровня Е, относятся следующие: функциональные особенности реагирующих
веществ, их концентрации, температура, присутствие в системе катализаторов. Скорости
некоторых гетерогенных реакций зависят также от интенсивности движения жидкости или газа
около поверхности, на которой происходит реакция. При вступлении в реакцию фщ. единиц
двух различных веществ образуются фщ. единицы третьего, четвертого и т.д. вещества,
которые заполняют соответствующие им фн. ячейки, хотя теоретически процесс представляется
в обратном порядке: вначале появляется невидимая фн. ячейка В нового качества,
затем происходит сближение явных фщ. единиц а и б и образование новой
фщ. единицы в, которая заполняет фн. ячейку В. Поэтому скорости реакций
зависят от способности реагирующих веществ образовывать новые фщ. единицы в силу своего
структурного строения, то есть пространственного расположения и взаимной связи исходных
фщ. единиц качественных подуровней, от пропорции и количества фщ. единиц а и
б, вступающих в реакции, что характеризуется их концентрацией.
Необходимым условием того, чтобы между частицами (молекулами,
ионами) исходных веществ произошло химическое взаимодействие, является их взаимное
сближение и столкновение друг с другом (соударение). Точнее говоря, частицы должны
сблизиться друг с другом настолько, чтобы атомы одной из них испытывали бы действие
электрических полей, создаваемых атомами другой. Только при этом станут возможны те
переходы электронов и перегруппировки атомов, в результате которых образуются молекулы
новых веществ - продуктов реакции. Однако не всякое столкновение молекул реагирующих
веществ приводит к образованию продукта реакции. Для того, чтобы произошла реакция,
то есть чтобы образовались новые молекулы, необходимо сначала разорвать или ослабить
связи между атомами в молекулах исходных веществ. На это надо затратить определенную
энергию. Если сталкивающиеся молекулы не обладают такой энергией, то их столкновение
не приведет к образованию новой молекулы: столкнувшись, они разлетаются в разные
стороны, как упругие шары.
Если же кинетическая энергия сталкивающихся молекул достаточна
для ослабления или разрыва связей, то столкновение может привести к перестройке атомов
и к образованию молекулы нового вещества. Поэтому лишь молекулы, обладающие избытком
энергии по сравнению со средним запасом энергии всех молекул, могут преодолеть такой
"энергетический барьер", чтобы войти в химический контакт друг с другом.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение
могло привести к образованию нового вещества, называется энергией активации данной
реакции. Молекулы, обладающие такой энергией, называются активными молекулами.
Избыточная энергия этих молекул может быть поступательной или вращательной для
молекулы в целом, колебательной для составляющих ее атомов, энергией возбуждения
для электронов и т.д. Для каждой конкретной реакции основное значение может иметь
какая-либо одна форма избыточной энергии. С ростом температуры число активных молекул
возрастает, вследствие чего и скорости химических реакций увеличиваются.
Энергия активации различных реакций различна. Ее величина
является тем фактором, посредством которого сказывается влияние природы реагирующих
веществ на скорость реакции. Для некоторых реакций энергия активации мала, для других,
наоборот, велика. Если энергия активации очень мала, то это означает, что значительная
часть столкновений между частицами реагирующих веществ приводит к реакции. Скорость
такой реакции велика. Напротив, если энергия активации реакции очень велика, то это
означает, что лишь очень малая часть столкновений взаимодействующих частиц приводит
к протеканию химической реакции. Скорость подобной реакции очень мала.
Реакции, требующие для своего протекания заметной энергии
активации, начинаются с разрыва или с ослабления связей между атомами в молекулах
исходных веществ. При этом вещества переходят в неустойчивое промежуточное состояние,
характеризующееся большим запасом энергии - активированный комплекс. Именно для его
образования и необходима энергия активации. Неустойчивый активированный комплекс
существует очень короткое время. Он распадается с образованием продуктов реакции,
при этом энергия выделяется. В простейшем случае активированный комплекс представляет
собой конфигурацию атомов, в которой ослаблены старые связи и образуются новые.
Активированный комплекс возникает в качестве промежуточного состояния в ходе как
прямой, так и обратной реакции. Энергетически он отличается от исходных веществ
на величину энергии активации прямой реакции, а от конечных - на энергию активации
обратной реакции. Активация молекул возможна при нагревании или растворении вещества,
при выделении энергии в ходе самой реакции, при поглощении ими квантов излучения
(светового, радиоактивного, рентгеновского и т.п.), под действием ультразвука или
электрического разряда и даже при ударах о стенку сосуда.
Скорость реакции часто зависит от присутствия в системе
"третьего" компонента, с которым реагенты могут образовывать активированный
комплекс. При этом изменение скорости реакции происходит за счет изменения энергии ее
активации, так как промежуточные стадии процесса будут другими. Добавленный компонент,
называемый катализатором, после разрушения активированного комплекса не входит в состав
продуктов реакции, поэтому общее уравнение процесса остается прежним. В большинстве
случаев действие катализатора объясняется тем, что он снижает энергию активации реакции.
В присутствии катализатора реакция проходит через другие промежуточные стадии, чем
без него, причем эти стадии энергетически более доступны. Иначе говоря, в присутствии
катализатора возникают другие активированные комплексы, причем для их образования
требуется меньше энергии, чем для образования активированных комплексов, возникающих
без катализатора. Таким образом энергия активации реакции понижается - некоторые
молекулы, энергия которых была недостаточна для активных столкновений, теперь
оказываются активными.
Если реакция A + B 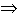 AB протекает с малой скоростью, то можно
найти вещество K, которое с одним из реагентов образует активированный комплекс,
взаимодействующий в свою очередь с другим реагентом:
AB протекает с малой скоростью, то можно
найти вещество K, которое с одним из реагентов образует активированный комплекс,
взаимодействующий в свою очередь с другим реагентом:
A + B 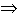 [A... K]; [A... K] + B
[A... K]; [A... K] + B 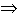 AB + K
AB + K
Если энергии активации этих стадий ниже энергии активации
процесса в отсутствие K, то общая скорость процесса значительно возрастает, и такой
катализ называется положительным. В противном случае скорость процесса уменьшится и
катализ будет отрицательным. Таким образом, катализатор - это вещество, изменяющее
скорость реакции и остающееся после нее химически неизменным. Катализатор, присутствующий
в системе в количествах, в тысячи раз меньших, чем реагенты, может в сотни, в тысячи и в
миллионы раз изменять скорость реакции. В некоторых случаях под действием катализаторов
могут возбуждаться такие реакции, которые без них в данных условиях практически
не протекают. Вместе с тем, с помощью катализатора можно изменить скорость лишь
термодинамически возможного процесса. Для замедления нежелательных процессов или для
придания реакциям более спокойного характера используются отрицательные катализаторы.
Различают гомогенный и гетерогенный катализ. В случае
гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ
или раствор). В случае гетерогенного катализа катализатор находится в системе
в виде самостоятельной фазы и реакция протекает на его поверхности.
Очень большую роль играет катализ в биологических системах.
Активными катализаторами биологического действия являются ферменты - простые и сложные
белки с большой молекулярной массой. Большинство химических реакций, протекающих в
пищеварительной системе, в крови и клетках животных и человека, являются каталитическими
реакциями. Так, слюна содержит фермент птиалин, который катализирует превращение крахмала
в сахар. Фермент, имеющийся в желудке - пепсин - катализирует расщепление белков.
Половина от имеющегося количества мочевины при 25oC в обычных
условиях разлагается водой за 3200 лет, а в присутствии фермента уреазы время
ее "полупревращения" при той же температуре составляет 10-4
сек. Всего в организме человека функционирует свыше 30 тыс. различных ферментов;
каждый из них служит эффективным катализатором соответствующей реакции.
Рассматривая гетерогенные реакции, нетрудно заметить, что
они тесно связаны с процессами перемещения фщ. единиц веществ, вступающих в реакцию,
и новых веществ. Так, для осуществления постоянного процесса горения угля необходимо,
чтобы диоксид углерода, образующийся при этой реакции, все время удалялся бы от
поверхности угля, а новые количества кислорода подходили бы к ней. Поэтому в ходе
гетерогенной реакции можно выделить по меньшей мере три стадии:
1) подвод реагирующих веществ;
2) химическая реакция;
3) отвод продуктов реакции.
Скорость химической реакции, которую в свою очередь можно разбить на подстадии,
определяется скоростью наиболее медленной подстадии. Стадия, определяющая скорость
протекания всей реакции в целом, называется лимитирующей стадией. В одном случае
это может быть отвод или подвод веществ, в другом - собственно химическая реакция.
Все химические реакции делятся на необратимые и обратимые.
Необратимые реакции протекают до конца - до полного израсходования одного из реагирующих
веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из
реагирующих веществ не расходуется полностью. Поэтому необратимая реакция может протекать
только в одном направлении, обратимая - как в прямом, так и в обратном направлениях. В
начале обратимой реакции, при смешении исходных веществ, скорость прямой реакции велика,
а скорость обратной - равна нулю. По мере протекания реакции исходные вещества
расходуются и их концентрации падают. В результате этого уменьшается скорость прямой
реакции. Одновременно появляются продукты реакции и их концентрация возрастает.
Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно
увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми,
наступает химическое (динамическое) равновесие.
Изменяя условия, в которых пребывает система, - концентрацию
веществ, давление, температуру - можно изменять скорости прямой и обратной реакций.
Тогда равновесие в системе нарушается и сдвигается в сторону той реакции, скорость
которой стала больше. Так, при увеличении концентрации реагентов скорость прямой реакции,
естественно, возрастает и равновесие смещается в сторону прямой реакции, в сторону
большего выхода продуктов. Большего выхода продуктов можно добиться и при систематическом
выведении их из сферы реакции, приводящем к снижению их концентрации в системе и к
уменьшению скорости обратной реакции по сравнению с прямой. Для химических систем,
содержащих газообразные вещества, изменение давления оказывает на смещение равновесия
влияние, аналогичное изменению концентрации газов. При этом в большей мере изменяется
скорость той реакции, в которой учавствует большее количество молекул газов. Изменение
температуры оказывает влияние на сдвиг химического равновесия для процессов,
сопровождающихся тепловыми эффектами. Если прямая реакция экзотермична, то обратная
- эндотермична, и наоборот. Для обратимых реакций энергия активации эндотермического
процесса больше энергии активации экзотермического процесса. В свою очередь, чем больше
Eакт., тем сильнее зависит скорость реакции от температуры. Следовательно,
увеличение температуры смещает химическое равновесие в сторону эндотермичной реакции,
в результате которой поглощается теплота и система охлаждается.
Сопоставляя изменения условий, при которых находится
химическая система, с ее ответной реакцией на внешнее воздействие, проявляющейся
в смещении химического равновесия, нетрудно заметить, что эта реакция всегда
оказывается противоположной изменению условия. Так, если уменьшают концентрацию
какого-либо из веществ, находящегося в равновесии с другими реагирующими веществами,
то равновесие сдвигается в сторону реакции, увеличивающей концентрацию этого вещества.
При увеличении давления быстрее начинает идти процесс, понижающий его, а при увеличении
температуры - процесс, вызывающий охлаждение системы. Эти наблюдения составляют
химическое содержание общего принципа поведения систем, находящихся при данных
условиях в состоянии динамического равновесия: если система, находящаяся в равновесии,
подвергнута воздействию извне путем изменения какого-либо из условий, определяющих
положение равновесия, то равновесие в ней смещается в сторону того процесса, который
ведет к снижению эффекта произведенного воздействия. Это правило противодействия
известно под названием принципа Ле Шателье, сформулированного им в 1884 году.
Итак, для проведения каждой химической реакции требуются
строго определенные реагенты в количествах, обеспечивающих требуемое протекание реакции
при заданном температурном и других режимах при определенной скорости, которую можно
соразмерить с временными интервалами. Кроме того, каждая химическая реакция, протекающая
при заданных условиях, имеет свою определенную системную конструкцию, представляющую
сочетание фн. ячеек, в определенные моменты заполняемые и освобождаемые соответствующими
им фщ. единицами согласно с характерным для данной реакции алгоритмом, отражающим моменты
вступления в реакцию реагентов - фщ. единиц, их возможное чередование, при этом все это
соотносится со строго определенными промежутками времени, зафиксированными независимым
счетчиком времени.

Уровень Ж
Все простейшие и сложные молекулярные соединения уровней
Г, Д и Е рассредоточены вдоль поверхности Земного шара и в соответствии
с их агрегатным состоянием входят в состав суши, океанов и атмосферы Земли.
Развитие Материи в подуровне Ж происходило за счет
формирования новых молекулярных соединений, наделявшихся все новыми функциями
в соответствии с движением Материи в качестве ( ). Дифференциация фн. ячеек и образование
новых фщ. единиц данного подуровня происходили в процессе постоянного комбинирования
фн. ячеек предшествующих подуровней, интеграционного варьирования их структур,
полураспада этих своеобразных микросистем на единицы нижних подуровней.
). Дифференциация фн. ячеек и образование
новых фщ. единиц данного подуровня происходили в процессе постоянного комбинирования
фн. ячеек предшествующих подуровней, интеграционного варьирования их структур,
полураспада этих своеобразных микросистем на единицы нижних подуровней.
Весь процесс Развития Материи в подуровне Ж протекал
и до сих пор протекает вот уже более 5 млрд. лет в геосферах Земли - сферических
оболочках различной плотности и состава. Главными из них являются атмосфера, гидросфера
и литосфера (земная кора), которые проникают одна в другую, находятся в тесном
взаимодействии, заключающемся в обмене веществом и энергией, и представяют единую
систему, пронизываемую Солнечной радиацией.
Внешней геосферой Земли является атмосфера, которая в свою
очередь делится на три подслоя: тропосферу, стратосферу и ионосферу. Каждая из этих
субсфер характеризуется резко выраженными физическими особенностями и несет строго
определенную функциональную нагрузку. Границы между этими слоями выражены нерезко,
а их высоты меняются как со временем, так и с широтой места. Верхняя граница тропосферы
находится в пределах от 8 до 18 км. Тропосфера объединяет более 79% массы атмосферы.
Стратосфера простирается до высоты около 80 км, составляя примерно 20% общей массы
атмосферы. Выше стратосферы расположена ионосфера, содержащая менее 0,5% всей массы
атмосферы.
Тропосфера, в которой сосредоточен почти весь водяной
пар, характеризуется почти полной прозрачностью по отношению к проходящей через
нее коротковолновой солнечной радиации и значительным поглощением длинноволнового
(теплового) излучения Земли, вызываемым главным образом водяным паром и облаками.
Поэтому тропосфера нагревается преимущественно от земной поверхности, следствием чего
является падение температуры с высотой. Это, в свою очередь, приводит к вертикальному
перемешиванию воздуха, конденсации водяного пара, образованию облаков и выпадению
осадков. В состав тропосферы входят (по объему): 78,08% азота; 20,95% кислорода;
0,93% аргона и около 0,03% углекислого газа. 0,01% составляют вместе водород,
неон, гелий, криптон, ксенон, аммиак, перекись водорода, йод и др.
Состав сухого воздуха в стратосфере отличается весьма важной
особенностью - возрастанием с высотой как общей концентрации, так и относительного
содержания озона (трехатомного кислорода). Озон образуется в стратосфере в результате
диссоциации молекул кислорода под действием ультрафиолетового излучения Солнца и
последующего соединения образовавшегося атома кислорода с другой молекулой кислорода.
Озон расположен в атмосфере в виде рассеяного слоя, простирающегося от Земной
поверхности примерно до 60 км. Если весь озон в атмосфере сконцентрировать в виде
слоя при наземном давлении, то образовалась бы пленка толщиной в 2 - 3 мм. Несмотря
на столь ничтожное количество, роль озона в атмосфере исключительно велика, вследствие
чрезвычайно сильного поглощения озоном как солнечной радиации, так и земного излучения.
Так, вследствие поглощения озоном ультрафиолетовое излучение Солнца почти совершенно не
доходит до тропосферы.
Ионосфера - внешняя область атмосферы, на которую падает
многообразное излучение Солнца и звезд. Ее состав в основном представлен атомарным
кислородом и рядом других веществ.
Между атмосферой и твердой каменной земной корой располагается
прерывистая водная оболочка - гидросфера, покрывающая в настоящее время 70,8% (361
млн. кв. км) поверхности Земли. Она представлят собой совокупность океанов, морей и
континентальных водных бассейнов. Химический состав гидросферы выражается следующими
цифрами: O - 85,82%, H - 10,72%, Cl - 1,9%, Na - 1,05%, Mg - 0,14%, S - 0,088%,
Ca - 0,04%, K - 0,038% и т.д. Возраст гидросферы составляет не менее 2 млрд. лет.
В гидросфере впервые зародилась Жизнь на Земле. Эволюция организмов продолжалась
здесь в течение всего докембрия, и лишь в начале палеозойской эры началось постепенное
переселение животных и растительных организмов на сушу. Главной составной частью
гидросферы является вода - одно из самых распространенных на Земле веществ. Много
воды находится в газообразном состоянии в виде паров в атмосфере; в виде огромных
масс снега и льда лежит она круглый год на вершинах высоких гор и в полярных областях.
В недрах Земли также находится вода, пропитывающая почву и горные породы. Вода имеет
довольно высокий коэффициент полифункциональности и несет на себе большой спектр
выполняемых функций. Являясь первой колыбелью происхождения Жизни, вода во всяком
организме представляет среду, в которой протекают химические процессы, обеспечивающие
жизнедеятельность организма; кроме того, она сама принимает участие в целом ряде
биохимических реакций. В виде различных растворов вода осуществляет функции перемещения
(транспортировки) различных фщ. единиц с места их синтеза до места функционирования в
структуре организма. Будучи весьма реакционноспособным веществом, вода является активным
химическим реагентом; часто выполняет функции катализатора. Обладая аномально высокой
теплоемкостью, служит в качестве естественного теплоаккумулятора.
Твердое тело Земли имеет три основных геосферы: ядро Земли,
промежуточную оболочку и земную кору. Радиус ядра около 3500 км. Промежуточная оболочка
заполняет пространство от поверхности ядра до нижней поверхности земной коры и имеет
толщину около 2900 км. Земная кора, или литосфера, является верхней твердой оболочкой
Земли толщиной 15 - 70 км; сверху она ограничена атмосферой и гидросферой. Земная кора
имеет слоистое строение, различное в разных местах. Самое верхнее положение занимает
осадочная оболочка (стратисфера). Она прерывиста, имеет мощность до 10 - 15 км и состоит
из осадочных горных пород, среди которых преобладают глины и глинистые сланцы. Пески и
песчаники, известняки и доломиты составляют меньшую ее часть.
Формирование стратисферы началось еще в древнем докембрии и
продолжается до сих пор. Общий возраст земной коры определяется в 3 - 3,5 млрд. лет,
однако возраст самых древних доступных наблюдению докембрийских геологических формаций
несколько превышает 2 млрд. лет. Осадочная оболочка образовалась в результате длительного
процесса дифференциации вещества литосферы под воздействием тектонических движений,
Солнечной энергии и жизнедеятельности организмов. Этот процесс сопровождался сложным
обменом веществ между гранитной и базальтовой оболочками Земли, с одной стороны, и
атмосферой и гидросферой - с другой. Химический состав стратисферы, в сумме с солевым
составом океана, близок к среднему составу земной коры в целом.
В течение геологической истории Земли происходили закономерные
изменения внутреннего строения и состава земной коры, рельефа ее поверхности, характера
внешних и внутренних геологических процессов. Так, например, породы древнейшей архейской
эры повсеместно сильно метаморфизованы (перекристаллизованы), пронизаны внедрениями магмы
и смяты в складки. По всей поверхности материков неоднократно возникали горы, которые
потом разрушались. В течение протерозоя и позднее материки, опускаясь, частично
заливались морем и, поднимаясь, вновь превращались в сушу. Одновременно в различных
местах происходили мощные движения земной коры, в результате которых возникали
многочисленные горные хребты, позднее разрушенные. Современные внутренние
геологические процессы проявляются:
1) в медленных поднятиях и опусканиях земной поверхности,
скорость которых в горных областях достигает нескольких сантиметров в год, но обычно
исчисляется миллиметрами в год;
2) в резких движениях отдельных участков земной
коры - землетрясениях;
3) в вулканических извержениях.
В результате вышеуказанных геологических процессов,
а также при постоянном воздействии со стороны атмосферы (включая солнечную и
космическую радиации), гидросферы и биосферы на протяжении двух млрд. лет
происходило формирование основного слоя литосферы - почвы.
Ее образование происходило из рыхлых горных пород, то
есть фщ. единиц подуровней Г - Е: глин, суглинков, супесей и песков,
представляющих собой продукты выветривания магматических, метаморфических или плотных
осадочных пород, залегающих на месте своего образования или, чаще, подвергшихся
переносу и переотложению (часто многократному) текучими водами или ветром. Почва
состоит из твердой, жидкой (почвенный раствор) и газообразной (почвенный воздух)
частей. В составе твердой части основную долю по массе занимает обычно минеральная
часть, представленная мелкими (чаще всего от 1 мм до десятых и сотых долей микрона)
частицами различных минералов. В состав почвы входят следующие химические соединения
(в убывающем порядке): SiO2, Al2O3,
Fe2O3, K2O, Na2O, MgO, CaO, CO2,
Cl, SO4 и многие другие. Но наиболее ценной составной частью почвы является
гумус, или перегной - конечный результат фукнционального Развития Материи по оргуровню
Ж. В состав гумуса входят различные высокомолекулярные кислоты, среди которых
наибольшее значение имеют группы гуминовых и ульминовх кислот и фульвокислот. Основу
сложных молекул гуминовых кислот составляют цепочки ароматических ядер типа двух- и
трехчленных фенолов. К ним присоединены различные функциональные группы: карбоксильные,
метоксильные, спиртовые и др.
Все многочисленные химические соединения подуровня Ж,
включая и гумусовые вещества, представляют собой сложные системные образования,
заключающие в свои фн. ячейки фщ. единицы всех предыдущих подуровней от а
до Д. Каждая из этих частиц в виде определенным образом организованных структур
Материи несет на своем оргуровне различные функциональные нагрузки, значительно
отличающиеся друг от друга. Однако, как это было и на предыдущих этапах Развития Материи,
каждое устоявшееся системообразование подуровня Ж в определенный момент становится
фщ. единицей следующего оргуровня - З (биосферы). И как только острие невидимой
линии тензора Развития Материи переместилось из уровня Ж в уровень З,
сразу же уровень Ж остался за пределами области актуального Развития Материи
и стал, как и все предыдущие оргуровни, поставщиком функциональных полуфабрикатов -
фщ. единиц своего подуровня - для построения фн. систем уровня З.
Своеобразным аккумулятором этих полуфабрикатов и служит
гумусовый горизонт почвы, состоящий главным образом из ее органического вещества.
Являясь самым верхним слоем почвы и непосредственно соприкасаясь с атмосферой и,
частично, с гидросферой, гумусовый горизонт имеет относительно небольшую толщину.
Она колеблется в разных почвах от нескольких сантиметров до одного, иногда до 1,5 м.
В районах пустынь, полупустынь, гор и т.п. гумусовый горизонт практически отсутствует.
Но и там, где он значителен, содержание гумуса в верхней части гумусового горизонта -
от десятых долей процента до 15 - 18%. Таким образом, образование, функционирование
и развитие фн. систем и фщ. единиц всех последующих оргуровней Материи находится в
прямой зависимости от количественного состава полуфабрикатов, находящихся в гумусовом
горизонте - аккумуляторе. А так как этот аккумулятор многие миллионы лет имеет
практически неизменную площадь ( ), он и является одним из основных естественных регуляторов
численности всего живого на Земле в точно такой же степени, в какой само все
живое на Земле во избежание худших последствий должно саморегулировать свою
численность в соответствии с возможностями этой ступени системной организации Материи.
), он и является одним из основных естественных регуляторов
численности всего живого на Земле в точно такой же степени, в какой само все
живое на Земле во избежание худших последствий должно саморегулировать свою
численность в соответствии с возможностями этой ступени системной организации Материи.

[ Оглавление ]
[ Продолжение текста ]
![]() + S
+ S![]()
![]() может протекать только на поверхности металла, потому что только здесь соприкасаются
друг с другом оба реагирующих вещества. Результатом реакции является опять гетерогенная
система, которая в условиях отсутствия замкнутости может путем освобождения от одной
из своих фаз стать гомогенной системой. В качестве примеров гетерогенных систем можно
привести следующие системы: вода со льдом, насыщенный раствор с осадком, сера в
атмосфере воздуха. На более высоких ступенях Развития Материи примерами гомогенных
систем могут служить заросли функционально однотипных растений (лес, луговая трава,
фруктовые сады), объединенные группы функционально однотипных животных (стадо овец,
стая волков или обезьян). Гетерогенными системами в этом случае будут: табун лошадей
на лугу, бригада лесорубов в лесу, производственные предприятия и т.п. Изучением
условий, влияющих на скорости химических реакций, занимается химическая кинетика.
На более высоких ступенях Развития Материи эти вопросы должны быть отнесены
соответственно к биологической и социальной кинетике.
может протекать только на поверхности металла, потому что только здесь соприкасаются
друг с другом оба реагирующих вещества. Результатом реакции является опять гетерогенная
система, которая в условиях отсутствия замкнутости может путем освобождения от одной
из своих фаз стать гомогенной системой. В качестве примеров гетерогенных систем можно
привести следующие системы: вода со льдом, насыщенный раствор с осадком, сера в
атмосфере воздуха. На более высоких ступенях Развития Материи примерами гомогенных
систем могут служить заросли функционально однотипных растений (лес, луговая трава,
фруктовые сады), объединенные группы функционально однотипных животных (стадо овец,
стая волков или обезьян). Гетерогенными системами в этом случае будут: табун лошадей
на лугу, бригада лесорубов в лесу, производственные предприятия и т.п. Изучением
условий, влияющих на скорости химических реакций, занимается химическая кинетика.
На более высоких ступенях Развития Материи эти вопросы должны быть отнесены
соответственно к биологической и социальной кинетике.![]() [A... K]; [A... K] + B
[A... K]; [A... K] + B ![]() AB + K
AB + K![]()
![]()